Hoe werken batterijen, en kan dat ook beter?

Batterijen kunnen elektriciteit omzetten in chemische energie – die dan weer vrijgemaakt kan worden om de stroom af te geven. Ze zitten in je telefoon, een zaklantaarn of in je auto (want een accu is ook een batterij). Het grootschalige gebruik van batterijen voor opslag van stroom uit wind- of zonneparken vraagt om nieuwe typen die efficiënter, goedkoper en milieuvriendelijker zijn. Aan de RUG werken wetenschappers aan deze nieuwe batterijen, maar ook aan het recyclen van afgedankte exemplaren. In een serie van 5 artikelen maak je kennis met de batterijenbouwers van de Faculty of Science & Engineering (FSE).
FSE Science Newsroom | René Fransen
Er is veel onderzoek nodig om de beste of de schoonste batterijen te ontwikkelen. De manier waarop het lithium voor de batterij van je telefoon, elektrische fiets of auto wordt gewonnen is bijvoorbeeld niet zo milieuvriendelijk. Daarom werken onderzoekers van FSE aan alternatieven, waarin lithium bijvoorbeeld is vervangen door natrium dat veel eenvoudiger te winnen is. Ook zoeken ze naar alternatieven voor zeldzame materialen, vooral om niet afhankelijk te zijn van de paar landen in de wereld waar ze worden gewonnen.

Waaruit bestaat een batterij
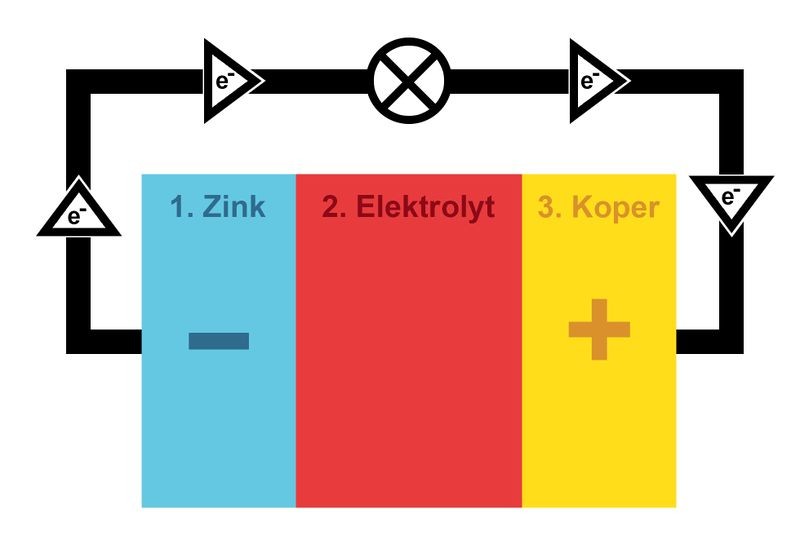
Batterijen zijn te maken met talloze combinaties van materialen. Een batterij (of accu) heeft in elk geval drie belangrijke onderdelen:
-
De minpool (anode), daar zitten deeltjes die elektronen kunnen afstaan.
-
De pluspool (kathode): daar zitten deeltjes die de afgestane elektronen kunnen opnemen.
-
Het elektrolyt: dit is de vloeistof (of een pasta) waardoor geladen deeltjes zich kunnen bewegen van pool naar pool. Dit is ook de stof die de chemische reacties in een batterij mogelijk maakt waardoor deze stroom afgeeft, of wordt opgeladen.
Anodes zijn meestal van grafiet (een vorm van koolstof) maar ook van metalen zoals aluminium, zink of magnesium. De kathodes bevatten vaak lithium maar ook mangaan, zilver of grafiet. En met een koperen muntje en een spijker kunt je zelfs een batterij maken van een aardappel!
Batterijen zijn er in allerlei soorten en maten. Er zijn ook batterijen die bestaan uit twee grote vaten met vloeistof, verbonden met een reactor die zorgt dat het ene vat positief geladen wordt en het andere negatief. Niet handig in je auto, wel voor het opslaan van een grote hoeveelheid overtollige stroom van bijvoorbeeld een windpark. Bij de Faculty of Science and Engineering werkt prof. Edwin Otten aan zo’n batterij.

Hoe loopt de stroom in een batterij?
Wanneer je een apparaat met een batterij aan zet, ontstaat er een route waarlangs elektronen van de minpool naar de pluspool stromen. Als die route via het lampje van je zaklantaarn gaan, zorgt de elektronenstroom ervoor dat het gaat branden.
Maar waarom kan de minpool eigenlijk elektronen afstaan? De atomen waarvan deze anode gemaakt is staan elektronen af door oxidatie, een chemische reactie die ontstaat tussen de anode en het elektrolyt, de vloeistof tussen de polen. Tegelijkertijd vindt aan de kathode de omgekeerde reactie plaats, die ‘reductie’ heet, waardoor deze elektronen opneemt. Daardoor loopt er een stroom van elektronen van de ene naar de andere pool. Bij opladen is dit proces omgekeerd.
Wanneer zich elektronen ophopen in de anode zullen die elkaar afstoten, omdat ze allemaal dezelfde (negatieve) lading hebben. Ze willen dan graag naar een plek gaan met minder vrije elektronen. Wanneer de batterij in een elektrisch circuit zit (zoals een zaklantaarn) dan zullen ze vanuit de anode het circuit in stromen, richting de kathode, de pluspool.
Tijdens het produceren van stroom vindt dus voortdurend een chemische reactie plaats die zorgt voor de aanvoer van elektronen. Tijdens het ontladen van een batterij (zoals bij het gebruik van je laptop of telefoon) vindt er dus voortdurend een chemische reactie plaats die zorgt voor een stroom van elektronen. Maar die reactie stopt wanneer de stoffen die nodig zijn voor de chemische reactie op zijn. De batterij is dan leeg.
In een oplaadbare batterij kan de chemische reactie twee kanten op: stroom produceren door oxidatie aan de anode die elektronen vrij maakt, en energie opslaan wanneer de batterij aan de lader ligt. Dan neemt de anode weer elektronen op door een reactie die ‘reductie’ heet. Als de batterij is opgeladen kan deze weer stroom leveren. De reacties waarbij stroom vrijkomt of wordt opgeslagen noemen we ‘elektrochemische reacties’.
Een probleem bij sommige batterijen is dat er ongewenste reacties kunnen plaatsvinden in het elektrolyt. Bij oplaadbare lithium-ion batterijen kan er tijdens het laden lithium vanuit het elektrolyt op de elektrode afgezet worden. Zo kunnen uitsteeksels van lithium groeien, die in de batterij voor kortsluiting zorgen. Dit gebeurt vooral bij snelladen. Bij FSE werkt Giuseppe Portale aan manieren om dit tegen te gaan, waardoor oplaadbare batterijen langer mee gaan en sneller kunnen laden.
Maar er zijn meer ongewenste reacties mogelijk. Voor wetenschappelijk onderzoek naar batterijen is het daarom belangrijk om te kunnen achterhalen welke elektrochemische reacties er allemaal plaatsvinden. Ook dit onderzoek vindt plaats in Groningen, onder meer door prof. Moniek Tromp. Verder experimenteren FSE wetenschappers met nieuwe materialen die de gewenste reacties kunnen opleveren, en onderzoeken ze de milieubelasting en recycling van de verschillende batterijen.
De volgende artikelen vind je in het venster hieronder.
Onderzoekers Xin Sun en Xiaohua Li kijken naar de levenscyclus van batterijen, van grondstoffen tot de verwerking van oude batterijen, en naar manieren om recycling efficiënter en groener te maken.
Er is een kleine kans dat oplaadbare lithiumbatterijen vlam vatten of exploderen. Giuseppe Portale, adjunct hoogleraar Polymeerchemie en -natuurkunde aan de RUG werkt daarom aan veiliger batterijen.
Edwin Otten werkt aan een batterij waarbij de stroom in grote vaten vol vloeistof zit. Om zo’n batterij effectief en betaalbaar te maken is nog wel veel onderzoek nodig.
Het Nationaal Groeifonds stimuleert het Nederlandse ‘ecosysteem’ voor batterijen met een programma van maar liefst 800 miljoen euro, met als doel een internationale speler te worden. RUG onderzoekers werken mee aan dit programma om de batterijen van de toekomst wil ontwerpen en bouwen.
Meer nieuws
-
10 maart 2026
Microplastics als een boemerang
-
17 februari 2026
De lange zoektocht naar nieuwe fysica
