Weg met de resistentie: waarom bacteriën samen sterker zijn
We weten dat frequent gebruik van antibiotica kan leiden tot resistentie in bacteriën, en we weten ook hoe ze genen voor deze resistentie aan elkaar doorgeven. Maar alleen naar ziekteverwekkers en genen kijken is te beperkt, stelt microbioloog Marjon de Vos. In haar onderzoek kijkt ze naar het bacteriële ecosysteem als geheel. Want het blijkt dat bacteriën die op het eerste gezicht onschuldige omstanders lijken, een belangrijke rol spelen in de ontwikkeling van resistentie.
FSE Science Newsroom | Tekst René Fransen | Beeld Leoni von Ristok
Dit is het derde artikel in een serie van drie over antibiotica resistentie. Het eerste artikel beschrijft nieuwe manieren om infecties te bestrijden, het tweede artikel gaat over een nieuwe manier om antibiotica te gebruiken met schakelaars en fluorescerende labels voor precisiebehandeling.
De Vos is ervan overtuigd dat de manier waarop we met infecties omgaan, te reductionistisch is. ‘Toen ik aan mijn postdoc bezig was, was de consensus dat de bacterie E. coli de voornaamste oorzaak is van urineweginfecties,’ vertelt ze. De aanwezigheid van een bacteriële gemeenschap (het microbioom) in de urinewegen, was toen nog onbekend. Dit is veranderd, deels door het werk van De Vos.
Een stabiel bacterieel ecosysteem

De Vos ontdekte stabiele bacteriële ecosystemen in de urine van geïnfecteerde vrouwen, in samenwerking met Britse en Duitse microbiologen. In eerste instantie werd gedacht dat de proefmonsters van de urine per ongeluk vervuild waren met een andere bacterie dan de veroorzaker van de infectie (waarvoor men E. coli als verdachte had aangewezen). Maar het bleek niet om vervuilde monsters te gaan, maar om verschillende bacteriën die gezamenlijk een stabiel ecosysteem in de urinewegen vormde. De Vos: ‘Door antibiotica te geven tegen E. coli, verstoor je dit ecosysteem. Maar na een tijd zal het terug gaan naar z’n oorspronkelijke samenstelling, wat betekent dat ook de infectie weer terugkomt.’
Een ziekteverwekker is niet in alle omstandigheden een ziekteverwekker
Alleen kijken naar de ziekteverwekker (E. coli in dit geval) werkt dus niet goed, stelt De Vos. ‘Ga maar na: zo’n ziekteverwekker is niet in alle omstandigheden een ziekteverwekker. E. coli bijvoorbeeld leeft normaal in de darmen, waar het onschadelijk is.’ Bovendien speelt de samenstelling van het bacteriële ecosysteem ook een rol. In de ‘vervuilde’ monsters zorgde de aanwezigheid van een bepaald type bacteriën, gram-positieve bacteriën, er zelfs voor dat E. coli veel sneller resistentie kon ontwikkelen, en dat de genen voor resistentie zich ook makkelijker konden verspreiden.
Antibiotica selecteren op basis van het ecosysteem
Bacteriën zijn in staat om genetische informatie met elkaar uit te wisselen, waarmee ze de resistentie dus aan elkaar door kunnen geven. Dit doen ze door ringen van DNA uit te wisselen: plasmiden, die doorgaans een aantal nuttige genen bevatten. Deze ringen kunnen zelfs tussen bacteriën van verschillende soorten worden uitgewisseld. Microbiologen hebben allerlei van dit soort DNA uitwisselende ringen gevonden met genen voor resistentie – maar wederom is het niet zo simpel als het lijkt. De Vos: ‘De cellen die zulke resistentie via plasmiden ontvangen worden niet altijd zelf resistent. De gewone bacteriële genen kunnen het effect van de resistentiegenen veranderen. En andere bacteriën in de urinewegen kunnen bepalen hoe resistent zulke bacteriën daadwerkelijk worden.’
Het is belangrijk dat dokters het hele ecosysteem in beeld hebben, zodat ze een ander antibiotica kunnen voorschrijven.
Het is inmiddels duidelijk dat de bacteriële gemeenschap in de urinewegen deels bepaalt hoe effectief antibiotica tegen een E. coli infectie zal zijn. ‘In mijn onderzoek probeer ik te begrijpen hoe dit soort processen verlopen,’ vertelt De Vos, die ervan overtuigd is dat dit onze omgang met infecties zal veranderen, en hun behandeling. ‘Bijvoorbeeld, het zou kunnen dat de aanwezigheid van twee specifieke bacteriesoorten de gevoeligheid van de infectie voor antibiotica beïnvloeden. Dan is het belangrijk dat dokters het hele ecosysteem in beeld hebben, zodat ze een ander antibiotica kunnen voorschrijven. Aan de andere kant zou het ook kunnen zijn dat het ecosysteem de werking van een bepaald type antibiotica juist versterkt.’
Vervuilde grond

De resistentie van bacteriën is niet alleen het gevolg van antibiotica. Pesticiden en zware metalen in vervuilde grond kunnen ook een rol spelen. ‘Bacteriën maken bijvoorbeeld gebruik van een speciaal mechanisme om zware metalen en andere stoffen uit hun systeem te krijgen: zogenaamde efflux pompen in hun celwand.’ Maar deze efflux pompen kunnen ook antibiotica uitwerken. ‘Dus dan heb je door gebruik van pesticiden en vervuilde grond een selectie gemaakt van bacteriën die een uitstekend mechanisme hebben om zich te ontdoen van antibiotica.’
One Health – een brede blik op infecties
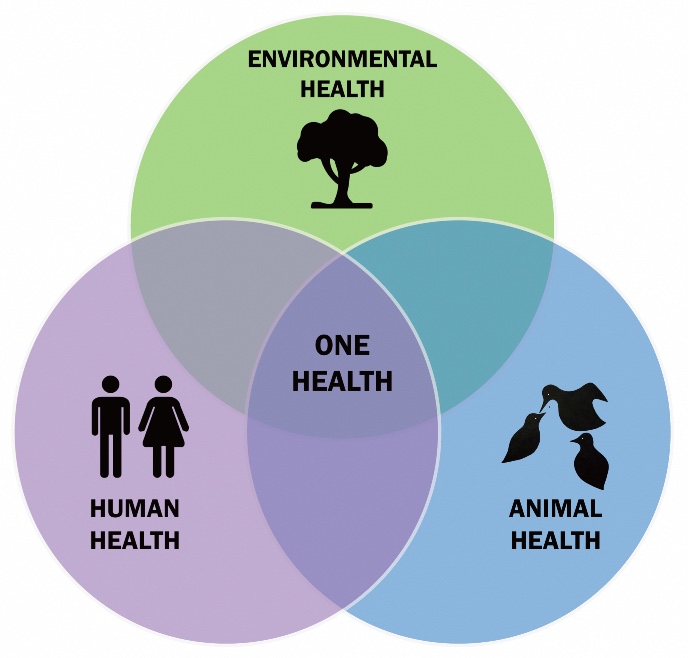
Menselijke ziektes zijn vaak verweven met dierenziektes, maar ook met het gehele milieu. Een voorbeeld is het griepvirus, dat vaak via varkens in intensieve veeteelt overspringt op mensen. Maar ook andere virussen, zoals HIV of SARS-CoV2, sprongen over van wilde dieren op mensen. Overeenkomsten tussen dier- en mensgeneeskunde werden al zo’n zestig jaar geleden opgemerkt. En ongeveer twintig jaar geleden werd het programma ‘One Health’ ingezet, waarbij menselijke gezondheid, diergezondheid en een gezonde omgeving werden samengebracht.
Zo wordt de One Health aanpak bijvoorbeeld ingezet om te analyseren hoe resistentie zich kan verspreiden via ziekenhuizen, of via landbouw. Het wordt ook gebruikt om systematisch te monitoren, detecteren en reageren op gezondheidsdreigingen in de intersectie van mens, dier en milieu, bijvoorbeeld om mogelijke pandemieën tijdig te detecteren. Maar, zegt De Vos, zelfs One Health is te veel gefocust op ziekteverwekkers en genen voor resistentie. ‘Dit is nog steeds een reductionistisch beeld, omdat het voornamelijk kijkt naar ziekteverwekkers en genen. Aan het Groningen Institute for Evolutionary Life Sciences hebben we een nog bredere blik, die ook kijkt naar processen van ecologie en evolutie.’
‘Alleen dan kunnen we een behandeling ontwikkelen die een positieve balans in het ecosysteem herstelt.’
Onbehandelbare infecties
De Vos geeft een laatste voorbeeld van het belang van het grotere plaatje. Wanneer een urineweginfectie met antibiotica wordt behandeld, doodt dat de E. coli bacterie. ‘Maar andere bacteriesoorten krijgen zo juist de kans om dit gat op te vullen – en soms zijn dat soorten die juist de groei van E. coli stimuleren!’ Zowel de diagnose als de behandeling zou het hele bacteriële ecosysteem in ogenschouw moeten nemen. ‘Alleen dan kunnen we een behandeling ontwikkelen die een positieve balans in het ecosysteem herstelt.’
De Vos is er vast van overtuigd dat we het bacteriële ecosysteem moeten begrijpen voordat we kunnen werken aan een oplossing. ‘Dit is belangrijk, omdat we nog steeds veel te veel antibiotica gebruiken, wat steeds meer resistentie teweeg brengt. Dat kan leiden tot een toename van onbehandelbare infecties – en dus een toename van sterfgevallen.’
Dit is het derde artikel in een serie van drie over antibiotica resistentie. Lees de andere artikelen hier:
Aangezien bacteriën steeds vaker resistent worden tegen antibiotica is het belangrijk om die geneesmiddelen zo weinig mogelijk te gebruiken. Wiktor Szymanski, hoogleraar Medische Chemie, Fotofarmacologie en Beeldvorming, werkt aan manieren om met licht bacteriële infecties op te sporen en op te ruimen.
Er zijn dringend nieuwe antibiotica nodig, omdat steeds meer bacteriën resistent zijn voor de huidige geneesmiddelen. RUG-onderzoekers Dirk-Jan Scheffers en Marthe Walvoort werken aan nieuwe manieren om de resistentie te doorbreken, door gaten te maken in bacteriën, of hun celwand te verzwakken.
Meer nieuws
-
17 februari 2026
De lange zoektocht naar nieuwe fysica
-
10 februari 2026
Waarom slechts een klein aantal planeten geschikt is voor leven
