Huntington-eiwit beter bekeken
Met vaste stof kernspinresonantie spectroscopie (ssNMR) is het mogelijk om de structuur van het gemuteerde Huntington-eiwit – de veroorzaker van de ziekte van Huntington – goed in beeld te brengen. Dat schrijven de groep van professor Van der wel van het Zernike Instituut (tijdens het onderzoek nog hoogleraar in Pittsburgh) en een groep onder leiding van professor De Paëpe uit Grenoble in Frankrijk in het wetenschappelijk tijdschrift Journal of the American Chemical Society. ‘Als we die structuur beter begrijpen, zal dat hopelijk helpen om slimmer medicijnen te kunnen ontwikkelen die de oorzaak van de ziekte aanpakken, in plaats van alleen symptomen te bestrijden.’
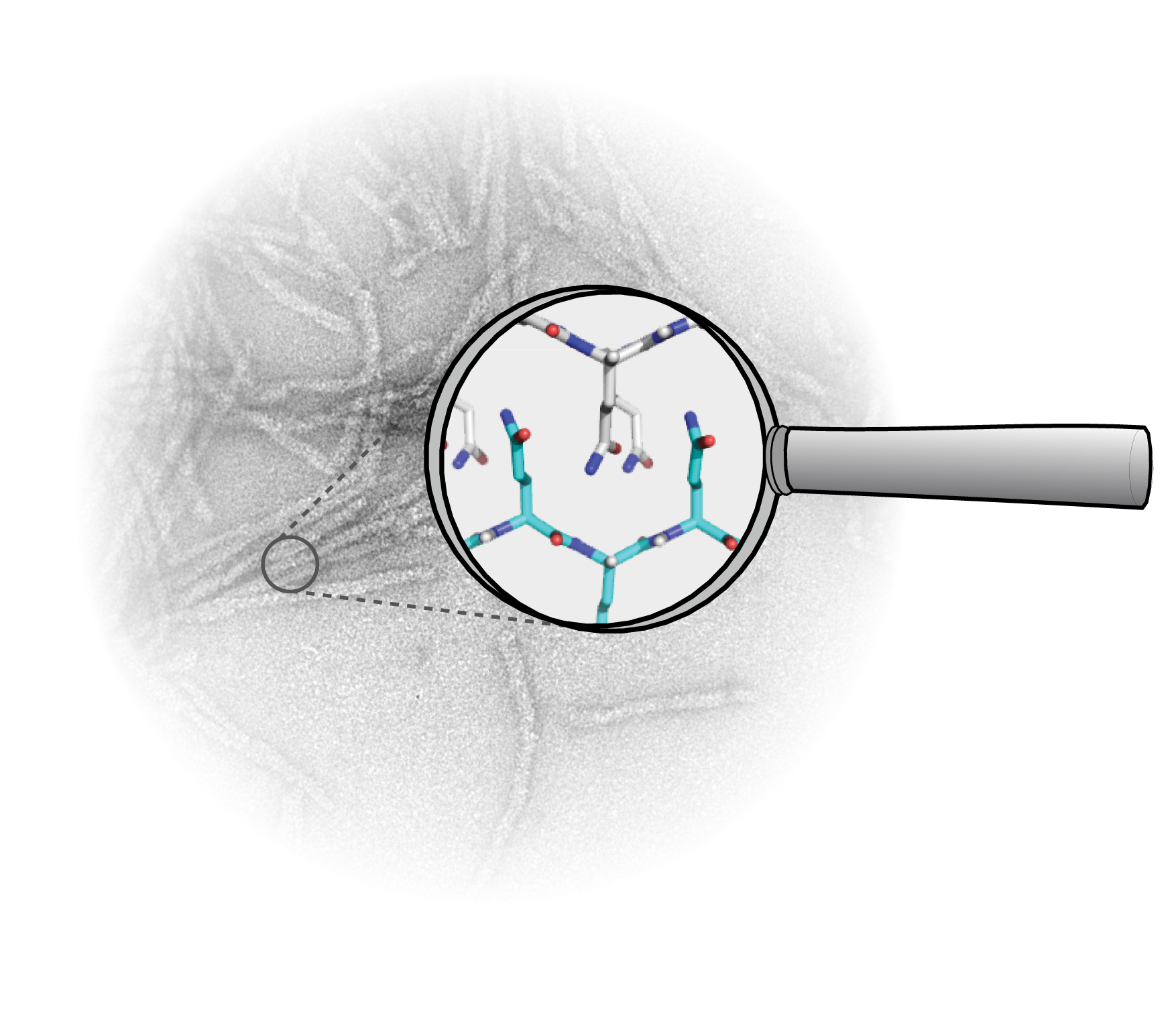
De ziekte van Huntington is een zogenaamde neurodegeneratieve ziekte, net als bijvoorbeeld de ziekte van Parkinson en Alzheimer. Bij neurodegeneratieve ziekten sterven na verloop van tijd grote aantallen neuronale cellen in het zenuwstelsel. Dat uit zich onder meer door verslechtering van de motoriek en het geheugen en leidt uiteindelijk tot vroegtijdig overlijden.
Eiwitaggregaten
Anders dan bij veel andere neurodegeneratieve ziekten is de oorzaak van het de ziekte van Huntington relatief duidelijk en voorspelbaar: patiënten hebben een apart soort mutatie in hun DNA dat verantwoordelijk is voor het al genoemde huntingtin-eiwit. Dit leidt tot het verkeerd vouwen van dit eiwit en het vormen van eiwitaggregaten, een soort eiwitklonten. Dergelijke eiwitklonteringen komen we ook bij andere neurodegeneratieve ziekten tegen. Het is niet bekend of en hoe deze eiwitklonten bijdragen aan het afsterven van de neuronen, mede doordat de structuur van het eiwit nog niet bekend is.
In het hart van het eiwit
Het is niet eenvoudig het eiwit in beeld te brengen. Met veelgebruikte technieken op basis van röntgenstraling diffractie en hoogstaande elektronenmicroscopie lukt dat nog niet. ‘Als je kijkt naar de structuur van het samengeklonterde eiwit kunnen je begrijpen waarom dat is,’ legt Van der Wel uit. ‘Het vormt als het ware een lange draad van duizenden eiwitten, waarvan geen kristallen zijn te maken. Bovendien lost slecht op en is ook heel wanordelijk en dynamisch.’ Twee jaar geleden lukte het voor de Van der Wel groep om voor het eerst in het hart van het eiwit te kijken, naar het gemuteerde deel. Dat werd mogelijk door een speciale vorm van spectroscopie, gebaseerd op het detecteren van kernspinresonantie, wat ook de basis is van MRI scanners. ‘Echter, dat kon toen alleen als we in het laboratorium het eiwit zelf namaakten met extra 13C-atomen erin. Die hadden we nodig om het eiwit goed te bekijken. In de natuur komt 13C weinig voor: van nature is maar één op de honderd koolstofatomen 13C. Dat is dus ook de toestand die je aantreft in eiwitten van natuurlijke bronnen, wat het moeilijk maakt om met onze techniek eiwitklonten uit mensen of dieren te bestuderen.’
Natuurlijke eiwitten
Dit geeft het belang van dit nieuwe onderzoek aan. ‘We hebben nu laten zien dat we het eiwit ook zorgvuldig kunnen bekijken zonder 13C toe te voegen. Dat kan het in de toekomst mogelijk maken om huntingtin-eiwitten uit organismen of levende cellen te bekijken om te zien of het eiwit dat we in het lab bekijken ook echt dezelfde structuur heeft. Dat is een essentiële volgende stap richting het goed begrijpen van de moleculaire oorsprong van de ziekte.’ De hoop is dat zulke informatie een rol kan spelen in het ontwikkelen van zowel medicijnen en signaalstoffen die de verkeerd gevouwen eiwitten herkennen en detecteren (ten bate van het stellen van diagnoses en prognoses).
Andere eiwitten
Het beter begrijpen van de ziekte van Huntington helpt mogelijk ook bij het begrijpen (en bestrijden) van andere neurodegeneratieve ziekten. ‘Het is helaas niet zo dat het makkelijk is deze techniek direct toe te passen op alle andere eiwitten. Om ook eiwitten van bijvoorbeeld de ziekten van Parkinson of Alzheimer te bekijken is meer werk nodig. Maar onze Franse collega’s gaan zeker verder met het doorontwikkelen van deze onderzoeksmethode.’
Smith A.N., Märker K., Piretra T., Boatz J.C., Matlahov I., Kodali R., Hediger S., van der Wel P.C.A., De Paëpe G. Structural fingerprinting of protein aggregates by DNP-enhanced solid-state NMR at natural isotopic abundance. J Am Chem Soc. 2018;140(44):14576-80. https://pubs.acs.org/doi/10.1021/jacs.8b09002
