Slim algoritme helpt bij diagnose van bijnierkanker

Gezwellen in de bijnier zijn bij ongeveer vijf procent van de bevolking aanwezig. Vaak komen ze bij toeval aan het licht, tijdens een scan van het onderlichaam voor hele andere redenen. Het is lastig om op basis van zo’n scan te bepalen of een gezwel goedaardig of kwaadaardig is. Een nieuwe methode gebruikt een algoritme om die twee typen te onderscheiden, op basis van afbraakproducten van steroïden in de urine. De methode, die deze zomer is gepubliceerd, is maar een van de toepassingen van het algoritme zegt Michael Biehl, hoogleraar Computerwetenschappen aan de RUG.
De publicatie in The Lancet Diabetes & Endocrinology van afgelopen juli heeft al heel wat aandacht getrokken. Daarin staat een onderzoek naar tweeduizend patiënten met een gezwel in de bijnier beschreven. ‘Goedaardige tumoren, de adenoma’s, komen veel voor, maar het kwaadaardige bijnierschorscarcinoom is zeldzaam. Daarom was er een onderzoek op Europese schaal voor nodig om genoeg patiënten te krijgen’, vertelt Biehl. Dit is gedaan binnen het European Network for the Study of Adrenal Tumours, ENS@T. Deze medische wereld staat nogal ver af van het beginpunt van Biehl’s carrière. ‘Ik ben natuurkundige, gespecialiseerd in theoretische en statistische natuurkunde’, legt hij uit. ‘Tijdens de jaren 1990 raakte ik betrokken bij onderzoek met kunstmatige neurale netwerken, waar ik vooral theoretische bijdragen aan leverde.’ Neurale netwerken zijn computersystemen die zijn gebaseerd op de werking van hersencellen. Ze kunnen leren en zijn daardoor te trainen voor allerlei verschillende taken.
Toeval
Na zijn overstap in 2003 naar de RUG raakte Biehl meer geïnteresseerd in praktische toepassingen. Samen met promovendi en collega’s ontwikkelde hij een nieuw lerend systeem: een algoritme dat de naam ‘Generalized Matrix Learning Vector Quantization’ draagt. Waar andere manieren van kunstmatige intelligentie op een nogal ondoorzichtige manier werken, werkt het GMLVQ systeem meer intuïtief, het kijkt naar typische patronen in gegevens. In het geval van gezwellen in de bijnier zoekt het naar patronen die kenmerkend zijn voor goedaardige of kwaadaardige tumoren. Dat Biehl onderzoek ging doen naar bijnierkanker kwam door een toevallige ontmoeting. In de tijd dat hij nog in het Duitse Würzburg werkte kwam hij endocrinoloog Wiebke Arlt tegen op een feestje. Zij verhuisde later naar de universiteit van Birmingham (VK). De twee hielden contact en gingen samenwerken aan de diagnose van bijniertumoren.
Patronen in meetwaarden
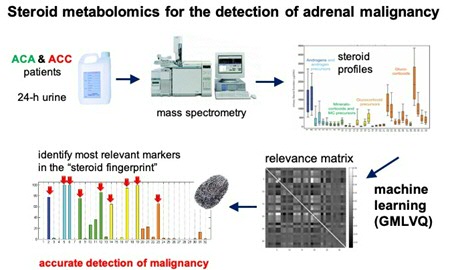
De bijnier scheidt steroïde hormonen uit, en het patroon daarvan kan veranderen in kwaadaardige bijniercellen. Endocrinologen maten de concentratie van maximaal 32 afbraakproducten van hormonen in de urine van patiënten. Biehl gebruikte vervolgens zijn algoritme om patronen te ontdekken in de meetwaarden. ‘Het GMLVQ systeem definieert eerst typische patronen voor goedaardige en kwaadaardige tumoren’, legt hij uit. ‘De gemeten waarden van de patiënten liggen rond de typische patronen. De kunst is om te bepalen bij welk patroon de waarden van een patiënt het beste passen.’ In een retrospectief onderzoek uit 2011, met data van 150 patiënten, lieten Arlt, Biehl en hun collega’s zien dat het algoritme in staat is onderscheid te maken tussen verschillende typen bijnier gezwellen. De volgende stap was om een prospectief onderzoek op te zetten, waarvoor ze grote aantallen nieuwe patiënten met een gezwel in de bijnier nodig hadden. Die zijn vervolgens onderzocht op de aanwezigheid van het gevaarlijke bijnierschorscarcinoom.
Artsen en computerwetenschappers samen
‘Het was een uitdaging om ons systeem te testen met echte gegevens’, zegt Biehl. Monsters kwamen van ziekenhuizen uit heel Europa. ‘In de vroege fase van het project waren er niet altijd gegevens over alle afbraakproducten, dus we moesten een methode hebben om daarmee om te gaan.‘ Voor dit onderzoek moesten bovendien artsen en computerwetenschappers nauw samenwerken. ‘Het was niet zo dat de endocrinologen de gegevens zomaar doorstuurden naar de computernerds. We hebben veel van elkaar geleerd, over hoe we onze technieken toepassen en de resultaten kunnen verbeteren.’ Promovendi uit beide onderzoeksgroepen worden begeleid door Biehl, Arlt en Kerstin Bunte (Rosalind Franklin Fellow bij het Bernoulli Instituut) via wekelijkse videomeetings. De intensieve samenwerking heeft mooie resultaten opgeleverd, zoals de publicatie in The Lancet Diabetes & Endocrinology. Door een aantal kenmerken te combineren is het onderscheid tussen verschillende tumoren in de bijnier beter te maken. Naast het patroon in de afbraakproducten worden ook de HU waarde (een maat voor de dichtheid van de tumor op een CT scan) en de grootte van het gezwel gebruikt om onderscheid te maken tussen patiënten met een hoog, gemiddeld of laag risico op bijnierschorscarcinoom. Hierdoor hoeven patiënten met een laag risico niet langer ingrijpende en dure vervolgonderzoeken te ondergaan.
Onderdeel van een nieuwe medische richtlijn
Biehl verwacht dat de methode onderdeel zal worden van een nieuwe medische richtlijn. ‘We moeten de techniek nog meer uniform maken en aanpassen aan een nieuwe manier om de afbraakproducten te meten.’ Bovendien is er onderzoek nodig naar welke afbraakproducten bekeken moeten worden. ‘De patronen die we daarin zien zeggen iets over wat er gebeurt in het lichaam van een patiënt’, legt Biehl uit. Daarmee is het mogelijk de ziekte beter te begrijpen, of onderscheid te maken tussen verschillende typen goedaardige tumoren. ‘Een soort daarvan is bijvoorbeeld de oorzaak voor het zogeheten syndroom van Cushing.’ Bovendien zou het mogelijk kunnen zijn om via de verandering in het patroon het succes van de behandeling van bijnierschorscarcinoom te voorspellen.
Meer toepassingen mogelijk
Naast de medische toepassing gebruikt Biehl het algoritme op andere terreinen, zoals genoomonderzoek en de indeling van sterrenstelsels door astronomen. ‘We werken ook samen met het Groningse Centrum voor Neuroimaging om de diagnose voor ziekten als Alzheimer of Parkinson te stellen. En er is nog een project met Birmingham, waarbij we op basis van de meting van ontstekingsfactoren in gewrichten proberen te zien of het gaat om een simpele ontsteking of reumatische artritis. Het is bijzonder om te zien hoe veelzijdig dit algoritme is.’
Meer informatie
- Michael Biehl
- Publicatie in The Lancet Diabetes & Endocrinology: Urine steroid metabolomics for the differential diagnosis of adrenal incidentalomas in the EURINE-ACT study: a prospective test validation study
Tekst: René Fransen
Meer nieuws
-
17 februari 2026
De lange zoektocht naar nieuwe fysica
-
10 februari 2026
Waarom slechts een klein aantal planeten geschikt is voor leven
