Bewegende moleculen onthullen inwendige structuur bacterie
Cellen zijn lang gezien als zakjes met daarin willekeurig verdeelde moleculen. Inmiddels weten we dat cellen met een celkern een soort mini-orgaantjes bezitten (de organellen). Dit zijn compartimenten waarin een specifieke taak wordt uitgevoerd. Hoewel bacteriën dit soort compartimenten niet bezitten zijn er steeds meer aanwijzingen dat ook deze cellen niet homogeen zijn. RUG-biochemici hebben nu de diffusie in bacteriecellen in kaart gebracht, waarbij ze verschillende regio’s konden onderscheiden. De resultaten zijn op 12 augustus gepubliceerd in het tijdschrift Science Advances.
‘We weten al heel veel van de compartimenten in eukaryote cellen, de cellen met een kern zoals wij die waaruit ons lichaam is opgebouwd. Maar we weten veel minder over de inwendige structuur van bacteriën, vooral omdat die veel kleiner zijn’, legt RUG-hoogleraar biochemie Bert Poolman uit. ‘Het oplossend vermogen van lichtmicroscopen is te klein om details in levende bacteriecellen te zien.’

Verplaatsing
Wat we wel weten is welke eiwitten en andere grote moleculen er in bacteriecellen zitten. Met behulp van fluorescerende labels is het ook mogelijk te meten hoe ‘druk’ het in de cel is. Dat is belangrijk voor ons begrip van de interacties tussen moleculen en de biochemische reacties die in cellen plaatsvinden. De mate van drukte is te schatten door te meten hoe gemakkelijk moleculen in een cel zich kunnen bewegen. Daarom was Poolman zeer geïnteresseerd toen hij op een conferentie een collega ontmoette die de beweeglijkheid van afzonderlijke moleculen kon meten in een zeer korte tijd. ‘We realiseerden ons dat wij dit zouden kunnen gebruiken om de structuur van het celvocht van bacteriën te onderzoeken.’
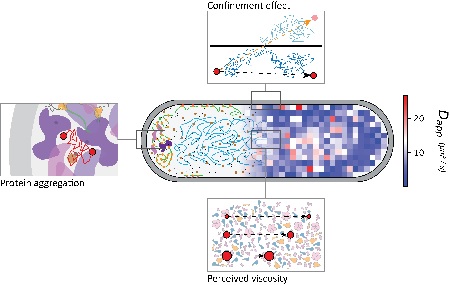
De techniek heet ‘single molecule displacement mapping’, een meting van de verplaatsing van afzonderlijke moleculen. ‘Het werkt door een fluorescerend label aan een molecuul te plakken. Dit label activeer je met laserlicht en vervolgens laat je het oplichten met behulp van een tweede laser. Dat signaal kun je uitlezen op een schaal van enkele milliseconden en zo kun je zien hoe ver een molecuul zich in de cel heeft verplaatst tussen twee metingen.’ Door de condities voor activatie precies goed te kezen is het mogelijk doorgaans slechts één molecuul tegelijk te meten. Door de meting enkele tienduizenden keren te herhalen kan de diffusiecoëfficiënt nauwkeurig worden bepaald in verschillende delen van een cel.
Hypothese
Poolman en zijn team gebruikten veertien verschillende eiwitten om er achter te komen wat de snelheid van hun diffusie in verschillende delen van de cel bepaalt. ‘We kozen daarvoor eiwitten die verschillen in de hoeveelheid interacties die ze met andere moleculen hebben, hun aantal in de cel en hun grootte.’ De hypothese was dat eiwitten die veel interacties aangaan zich langzamer door de cel bewegen. ‘Maar dat klopte niet’, legt Poolman uit. ‘En we vonden ook geen verband tussen de beweeglijkheid en het aantal kopieën van een molecuul in de cel. De enige factor die de diffusiesnelheid bepaalt bleek hun effectieve grootte te zijn.’
Einstein
Een interessante observatie was dat de diffusie-coëfficiënt zich niet hield aan de klassieke Stokes-Einstein formule, die de random Brownse beweging van moleculen beschrijft. ‘In een verdunde oplossing ervaren alle moleculen dezelfde stroperigheid, onafhankelijk van hun grootte. Maar in het celvocht bleek dat moleculen een stroperigheid voelen die afhangt van hun grootte. Daarom voelt het celvocht stroperiger voor grote moleculen dan voor kleine, zodat ze dus trager bewegen.’
De diffusie coëfficiënten van de veertien eiwitten is ook gemeten in verschillende segmenten van de bacteriecel: het middensegment (ongeveer 60 procent van het celvolume) waarin het DNA zich bevindt, en de twee polen (links en rechts) met elk 20 procent van het volume. ‘Onze metingen lieten zien dat de diffusiecoëfficiënt het hoogst is in het middensegment. En opvallend genoeg was de vertraging in de diffusie die we aan beide polen zagen groter dan we hadden verwacht op basis van de geometrie van deze segmenten’, vertelt Poolman. ‘Vermoedelijk komt dit doordat grote moleculaire complexen, zoals de ribosomen die eiwitten produceren, door het DNA uit het middensegment worden geduwd richting de polen. Dat zou verklaren waarom de mobiliteit daar lager is.’
Geoptimaliseerd
De mobiliteit van moleculen in cellen is al niet heel groot, omdat het celvocht vol zit. Poolman: ‘In een cel is de diffusiecoëffiënt tien tot honderd keer kleiner dan in water.’ Als de drukte in de cel nog eens 20 tot 30 procent toeneemt, bijvoorbeeld omdat de hoeveelheid water in de cel afneemt door veranderingen in de omgeving, zitten de moleculen zo stijf opeengepakt dat ze elkaar helemaal niet meer kunnen vinden. Dan stoppen alle biochemische reacties. ‘De drukte in de cel lijkt geoptimaliseerd voor een hoge reactiesnelheid. Maar een kleine verschuiving vermindert die snelheid, omdat de toenemende drukte in de cel de interacties tussen moleculen verhindert. We moeten nu uitzoeken hoe de verschillen in diffusie tussen polen en het middensegment in de cellen precies ontstaan.’
Referentie: Wojciech M. Śmigiel, Luca Mantovanelli, Dmitrii S. Linnik, Michiel Punter, Jakob Silberberg, Limin Xiang, Ke Xu en Bert Poolman: Protein diffusion in Escherichia coli cytoplasm scales with the mass of the complexes and is location dependent. Science Advances, 12 Augsust 2022
Meer nieuws
-
19 december 2025
Mariano Méndez ontvangt Argentijnse RAÍCES-prijs
-
18 december 2025
Waarom innoveren, en voor wie?
-
17 december 2025
Ben Feringa wint Feynmanprijs
