Doorbraak in glutamine-onderzoek; op weg naar een potentieel geneesmiddel tegen kanker
Om snel te kunnen groeien, moeten kankercellen sneller dan gezonde cellen voedingsstoffen opnemen. De menselijke glutaminetransporter ASCT2 maakt het voor het aminozuur glutamine mogelijk om cellen binnen te dringen en wordt in vele soorten kankercellen, die meer glutamine nodig hebben, gestimuleerd. Het is een potentieel doelwit voor nieuwe geneesmiddelen tegen kanker. Onderzoekers van de Rijksuniversiteit Groningen hebben nu een structuur van het menselijke ASCT2 aan het licht gebracht, dat een ongekend inzicht biedt in de werking van dit eiwit en kan helpen bij de ontwikkeling van kankermedicijnen. De resultaten zijn op 31 juli 2019 in Nature Communications gepubliceerd.

Met dit onderzoek konden de wetenschappers een oud raadsel oplossen. Het was bekend dat deze glutaminetransporters werken zoals een lift, waarbij het substraat glutamine door het eiwit wordt vastgehouden, en vervolgens over een lange afstand door het celmembraan wordt gedragen, van de buitenkant naar de binnenkant van de cel. Het was wel bekend hoe het substraat buiten de cel in de lift komt, maar het was tot nu toe een raadsel wat er aan de binnenkant gebeurt. Nu laat deze studie voor het eerst zien hoe de getransporteerde glutamine in het cytoplasma van de cel wordt vrijgegeven. Het vrijgavemechanisme lijkt verrassend veel op het vangmechanisme aan de buitenkant van de cel. Aan beide zijden van het membraan wordt gebruik gemaakt van dezelfde poort, ofwel de liftdeur. Dirk Slotboom, RUG-hoogleraar Biochemie: “Daarom hebben we het vervoersmechanisme een 'one-gate lift' genoemd, waardoor het zich onderscheidt van de vaker waargenomen mechanismen die twee verschillende poorten gebruiken voor binnenkomst en vrijgave."
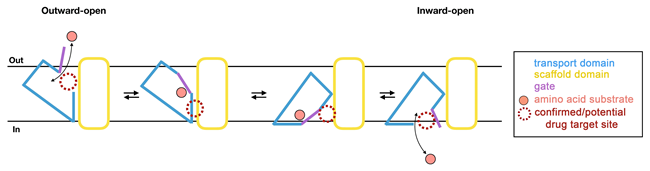
Dr. Cristina Paulino, hoofd van de cryo-elektronenmicroscopie groep van de afdeling Structurele Biologie: “Deze observatie is van groot fundamenteel belang, maar heeft ook potentiële implicaties voor het ontwerpen van geneesmiddelen. Een prominent gevolg van het liftmechanisme met één poort is dat tijdens het vervoer grote eiwitbewegingen in het celmembraan plaatsvinden. Daarom lijkt het ons waarschijnlijk dat lipiden (de moleculen waaruit het celmembraan is opgebouwd) de werking van het eiwit beïnvloeden."
De auteurs vinden inderdaad veel lipide-achtige moleculen die met het eiwit verbonden zijn, doordat ze holtes op het oppervlak innemen. Omdat deze holtes moeten worden vrijgemaakt voordat de lift kan bewegen, kunnen kleine moleculen die zich nauw aan deze locaties hechten, geneeskrachtige eigenschappen hebben.
Toekomstige studies richten zich op het zoeken naar en karakteriseren van dergelijke moleculen, wat in de nabije toekomst kan leiden tot de ontwikkeling van nieuwe geneesmiddelen tegen kanker.
Referentie
Nature Communications: 'A one-gate elevator mechanism for the human neutral amino acid transporter ASCT2', by Alisa A. Garaeva, Albert Guskov, Dirk J. Slotboom and Cristina Paulino - https://www.nature.com/articles/s41467-019-11363-x
Meer nieuws
-
17 februari 2026
De lange zoektocht naar nieuwe fysica
-
10 februari 2026
Waarom slechts een klein aantal planeten geschikt is voor leven
