
EC: 2.8.3.5
Succinyl-CoA acetoacetate transferase
Ketonlichamen, acetoacetaat en D3-hydroxybutyraat, worden gevormd bij overmatig vetafbraak, vasten of diabetus. Ze zijn belangrijk als oxidatieve substraten voor perifeer weefsel, als lipogene voorlopers en als regulatoren voor het metabolisme. Hun serumconcentratie wordt bepaald door het evenwicht tussen de aanmaak in de lever en het verbruik in perifeer weefsel. Een stijging in deze concentratie kan leiden tot ketoacidose en kan veroorzaakt worden door verhoogde aanmaak (bv. diabetus), verminderd verbruik en verandering in ketonlichaam-metabolisme.
Omim
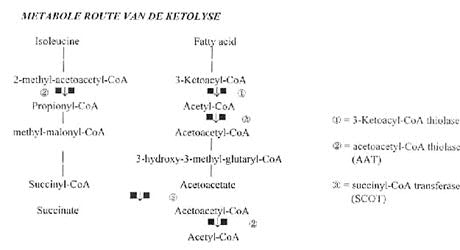
Als een kind telkens terugkerende ketoacidotische aanvallen, normaal of verhoogde bloedglucose waarden, normaal of lage lactaat en ammonia waarden en sterke ketonurie vertoond, is er een kans op een deficientie van 2-methylacetoacetyl-CoAthiolase of van succinyl-CoA acetoacetaat transferase (SCOT).
Succinyl-CoA acetoacetaat transferase (EC 2.8.3.5) wordt ook wel succinyl-CoA transferase en 3-oxoacid-CoA transferase (3-OAT) genoemd. Deficiëntie van dit enzym, een autosomaal recessieve afwijking, is een zeldzame afwijking. De ziekte is potentieel fataal bij kinderen met aanvallen met ernstige ketoacidose-aanvallen gecombineerd met vaak ernstige infecties, maar met een goed dieet is het mogelijk dat kinderen normaal opgroeien.
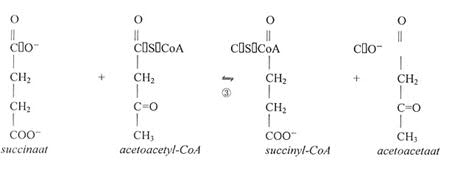
De activiteit van SCOT wordt bepaald door de afname van acetoacetyl-CoA in de aanwezigheid van succinaat spectrofotometrisch te bepalen bij 303 nm.
SwissProt
Structure
Benodigd materiaal: fibroblasten
Referenties:
-
D.H. Williamson, M.W. Bates, M.A. Page, H.A. Krebs, Activities of Enzymes involved in Acetoacetate Utilization in Adult Mammalian Tissues, Biochem. J., 121, 41-47 (1971).
-
B. Middleton, The acetoacetyl-Coenzym A Thiolases of Rat Brain and their Relative Activities during Postnatal Development, Biochem. J. 132, 731-737 (1973).
-
H. Schulz, H. Staack, 3-Ketoacyl-CoA-Thiolase with Broad Chain Lenght Specificity from Pig Heart Muscle, Methods in Enzymology, Vol. 71, 398-403 (1981).
-
J.V. Leonard, B. Middleton, J.W.T. Seakins, Acetoacetyl CoA Thiolase Deficiency Presenting as Ketotic Hypoglycemia, Pediatric Research Vol. 21 No. 2: 211-213 (1987).
-
J.M. Saudubray, N. Specola, B. Middleton, . Lombes, J.P. Bonnefont, C. Jakobs, A. Vassault, C. harpentier, R. Day, Hyperketotic States Due to Inherited Defect of Ketolysis, Enzyme 38: 80-90 (1987).
-
K.E. Niezen-Koning, R.J.A. Wanders, J.P.. Ruiter, G. Visser, W.C.C. Reitsma-Bierens, H.S.A. Heymans, D.J. Reijngoud, G.P.A. Smit, Succinyl-CoA acetoacetate transferase deficiency: identification of the second patient with a neonatal onset presenting an uncomplicated clinical course, Chapter 6.2, p 79-83.
-
Mitchell GA, Fukao T. Inborn Errors of Ketone Body Metabolism. In:Scriver CR, Beaudet AL, Sly WS, Valle D, eds.The Metabolic and Molecular Bases of Inherited Disease. 2001; 8 edtion: 2327-2357
