
EC 1.3.99.3
MCAD (aandoening: Medium Chain Acyl-dehydrogenase Deficiëntie)
Structure
Bepaling van acyl-CoA-dehydrogenase in leukocyten en fibroblasten
Tijdens perioden van vasten, vormen vetzuren de belangrijkste bron voor energieproduktie. Vooral in lever, hartspier en skeletspieren worden vetzuren geoxideerd; de hersenen metaboliseren vetzuren niet rechtstreeks, maar oxideren ketonlichamen, die gevormd worden door partiële oxidatie van vetzuren in de lever.
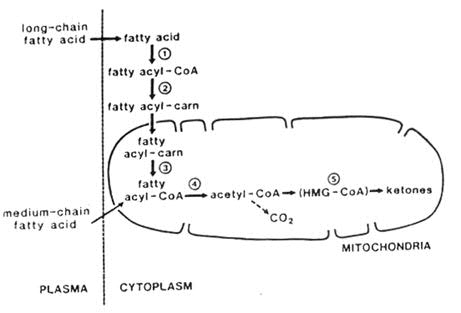
Vetzuren worden gemobiliseerd uit vetweefsel en via de bloedbaan getransporteerd, waarbij ze grotendeels gebonden zijn aan albumine. Door concentratie-afhankelijke mechanismen worden vetzuren opgenomen in de lever en andere organen. Eenmaal ìn de cel worden vetzuren met behulp van acyl-CoA-synthase omgezet in acyl-CoA-esters. Deze acyl-CoA-esters kunnen als substraat dienen voor triglyceride-, phospholipide- en cholesterylester synthese, maar tijdens perioden van vasten worden ze voornamelijk de mitochondriële ß-oxidatie ingesluisd.
Om de mitochondriële membraan te kunnen passeren, moeten lang-keten acyl-CoA-esters eerst getransesterificeerd worden aan carnitine. Dit gebeurt met behulp van het enzym carnitine palmitoyl transferase I (CPT I), wat zich aan de buitenkant van het membraan bevindt. Carnitine-translocase zorgt voor het transport van acyl-carnitines over de membraan. Eenmaal in de mitochondriële matrix worden acyl-carnitines gereësterificeerd tot acyl-CoA-esters door carnitine-palmitoyl-transferase II (CPT II).
Middenlangketen- en kortketen-vetzuren kunnen de mitochondriënmembraan als vrije zuren passeren; hierbij is geen carnitine-esterificatie nodig. In de mitochondriële matrix worden ze geactiveerd tot acyl-CoA-vetzuren. Acyl-CoA-vetzuren ondergaan mitochondriële ß-oxidatie. Met elke ronde van de ß-oxidatie-spiraal, wordt de ketenlengte van een verzadigd acyl-CoA-vetzuur verkort met 2 koolstofatomen, doordat een acetyl-CoA groep wordt afgesplitst. In de meeste weefsels, waaronder hart en skeletspieren, wordt acetyl-CoA via de citroenzuurcyclus geoxideerd tot koolstofdioxide en water. In de lever (en in mindere mate in de nieren) wordt acetyl-CoA dat afkomstig is van de ß-oxidatie, grotendeels via het 'hydroxymethylglutaryl-CoA (HMG-CoA) pad' omgezet in ketonlichamen, ß-hydroxy-boterzuur en acetoacetaat; deze stoffen worden daarna afgevoerd voor verdere oxidatie door onder andere de hersenen.
Omim
Elke ronde van de ß-oxidatie-spiraal wordt gereguleerd door een reeks van enzymen, waarvan sommige specificiteit bezitten voor de ketenlengte van het acyl-CoA vetzuur. Voor een verzadigd acyl-CoA vetzuur (zoals bijvoorbeeld palmitoyl-CoA (C16)) worden vier enzymstappen gevolg, te weten die van:
1. acyl-CoA dehydrogenase
2. enoyl-CoA hydratase
3. ß-hydroxyacyl-CoA dehydrogenase
4. ß-ketoacyl-CoA thiolase.

De ketenlengte-specifieke acyl-CoA dehydrogenase enzymen zijn flavoproteïnen; in het proces waarbij een dubbele binding gevormd wordt tussen het a- en ß- koolstofatoom van een acyl-CoA-vetzuur (en waarbij dus het corresponderende enoyl-CoA-vetzuur ontstaat), worden de vrijgekomen elektronen afgegeven aan ETF (elekton transfer proteïn) of ETF-dehydrogenase; dit complex legt de link tussen ß-oxidatie en ademhalingsketen.
De tweede reaktie in de ß-oxidatie wordt gekatalyseerd door enoyl-CoA hydratase (crotonase). Het enoyl-CoA-vetzuur wordt hierbij gehydrateerd tot een L-ß-hydroxyacyl-CoA-vetzuur.
Vervolgens katalyseert ß-hydroxyacyl-CoA dehydrogenase (bestaande uit 1 of meer enzymen) in een NAD+-afhankelijke reaktie, oxidatie van de hydroxy-groep tot een ketogroep.
Bij de laatste reaktie, die gekatalyseerd wordt door ß-ketoacyl-CoA thiolase (ook weer bestaand uit 1 of meer enzymen) wordt in aanwezigheid van gereduceerd CoA, de a-ß binding verbroken. De twee produkten die bij deze reaktie ontstaan zijn acetyl-CoA, en een acyl-CoA vetzuur dat 2 koolstofatomen korter is dan het oorspronkelijke substraat.
Zolang acyl-CoA-vetzuren een acetyl-CoA fragment af kunnen splitsen, kunnen ze de ß-oxidatie blijven doorlopen.
Er bestaan drie acyl-CoA dehydrogenase enzymen, die ieder een verschillende ketenlengte-specificiteit bezitten; hoewel er overlap bestaat tussen deze enzymen, kan gezegd worden dat in de lever (V)LCAD ((Very) Long Chain Acyl-CoA Dehydrogenase) de eerste reaktie in de ß-oxidatie katalyseert voor acyl-CoA-vetzuren met een ketenlengte van 18 tot 12 koolstofatomen. MCAD (Medium Chain AD) herkent acyl-CoA-vetzuren met een ketenlengte variërend van 14 tot 4 koolstofatomen, en SCAD ( Short Chain AD) herkent alleen vetzuurketens van 4en 6 koolstofatomen.
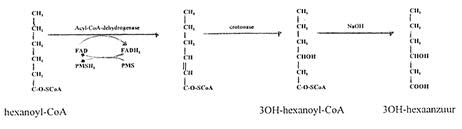
Principe van de enzymassay:
Aan een monster wordt een substraatmix met o.a. hexanoyl-CoA, FAD, phenazine methosulphate (PMS), en crotonase toegevoegd. Door de in het monster aanwezige Medium Chain Acyl CoA dehydrogenase wordt hexanoyl-CoA omgezet in 3OH-hexanoyl-CoA, waaruit vervolgens door hydrolyse met NaOH, 3OH-hexaanzuur ontstaat. De concentratie 3OH-hexaanzuur wordt met behulp van GCMS bepaald (aan de hand van de ratio 12C/13C-3OH-hexaanzuur).
SwissProt
Structure
Gene review
Benodigd Materiaal: Leukocyten en Fibroblasten.
Referenties:
-
Kølvraa S, et al., Clin. Chem. Acta (1982), 126:53.
-
Niezen k, et al, Clin. Chem. Acta (1991), 98: 173-184.
-
Niezen K, Mitochondrial ß-Oxidation; genetic deficiency and therapy, Thesis Groningen, 1995.
-
Roe CR, Ding J, Mitochondrial Fatty Acid Oxidation Disorders. In:Scriver CR, Beaudet AL, Sly WS, Valle D, eds.The Metabolic and Molecular Bases of Inherited Disease. 2001; 8 edtion: 2297-2327
